Nosokomial lunginflammation är den vanligaste och allvarligaste nosokomiala infektionen, varav ventilatorassocierad lunginflammation (VAP) står för 40 %. VAP orsakad av refraktära patogener är fortfarande ett svårt kliniskt problem. I åratal har riktlinjer rekommenderat en rad interventioner (såsom riktad sedering, huvudhöjning) för att förebygga VAP, men VAP förekommer hos upp till 40 % av patienterna med trakealintubation, vilket resulterar i längre sjukhusvistelser, ökad antibiotikaanvändning och dödsfall. Människor letar alltid efter mer effektiva förebyggande åtgärder.
Ventilatorassocierad lunginflammation (VAP) är en ny debut av lunginflammation som utvecklas 48 timmar efter trakealintubation och är den vanligaste och dödligaste nosokomiala infektionen på intensivvårdsavdelningen (IVA). Riktlinjerna från American Society of Infectious Diseases från 2016 har särskiljt VAP från definitionen av sjukhusförvärvad lunginflammation (HAP) (HAP avser endast lunginflammation som uppstår efter sjukhusvistelse utan trakealtub och är inte relaterad till mekanisk ventilation; VAP är lunginflammation efter trakealintubation och mekanisk ventilation), och European Society och Kina anser att VAP fortfarande är en speciell typ av HAP [1-3].
Hos patienter som får mekanisk ventilation varierar incidensen av VAP från 9 % till 27 %, dödligheten uppskattas till 13 % och kan leda till ökad systemisk antibiotikaanvändning, förlängd mekanisk ventilation, förlängd intensivvårdsvistelse och ökade kostnader [4-6]. HAP/VAP hos patienter utan immunbrist orsakas vanligtvis av bakteriell infektion, och fördelningen av vanliga patogener och deras resistensegenskaper varierar beroende på region, sjukhusklass, patientpopulation och antibiotikaexponering, och förändras över tid. Pseudomonas aeruginosa dominerade VAP-relaterade patogener i Europa och Amerika, medan fler Acinetobacter baumannii isolerades på tertiära sjukhus i Kina. En tredjedel till hälften av alla VAP-relaterade dödsfall orsakas direkt av infektionen, med en högre dödlighet i fall orsakade av Pseudomonas aeruginosa och acinetobacter [7,8].
På grund av den starka heterogeniteten hos VAP är den diagnostiska specificiteten för dess kliniska manifestationer, bilddiagnostik och laboratorietester låg, och differentialdiagnoserna är breda, vilket gör det svårt att diagnostisera VAP i tid. Samtidigt utgör bakteriell resistens en allvarlig utmaning för behandlingen av VAP. Det uppskattas att risken för att utveckla VAP är 3 %/dag under de första 5 dagarna av användning av mekanisk ventilation, 2 %/dag mellan 5 och 10 dagar och 1 %/dag under resten av tiden. Toppincidensen inträffar vanligtvis efter 7 dagars ventilation, så det finns ett fönster där infektion kan förebyggas tidigt [9,10]. Många studier har undersökt förebyggandet av VAP, men trots årtionden av forskning och försök att förebygga VAP (såsom att undvika intubation, förhindra reintubation, minska sedering, höja huvudändan med 30° till 45° och munvård) verkar incidensen inte ha minskat och den därmed sammanhängande medicinska bördan är fortfarande mycket hög.
Inhalerade antibiotika har använts för att behandla kroniska luftvägsinfektioner sedan 1940-talet. Eftersom det kan maximera läkemedelsleveransen till infektionsmålet (dvs. luftvägarna) och minska systemiska biverkningar, har det visat gott tillämpningsvärde vid en mängd olika sjukdomar. Inhalerade antibiotika är nu godkända av US Food and Drug Administration (FDA) och European Medicines Agency (EMA) för användning vid cystisk fibros. Inhalerade antibiotika kan avsevärt minska bakteriemängden och frekvensen av exacerbationer vid bronkiektasi utan att öka de totala biverkningarna, och nuvarande riktlinjer har erkänt dem som förstahandsbehandling för patienter med pseudomonas aeruginosa-infektion och frekventa exacerbationer. Inhalerade antibiotika under den perioperativa perioden efter lungtransplantation kan också användas som adjuvanta eller profylaktiska läkemedel [11,12]. Men i de amerikanska VAP-riktlinjerna från 2016 saknade experterna förtroende för effektiviteten hos adjuvanta inhalerade antibiotika på grund av bristen på stora randomiserade kontrollerade studier. Fas 3-studien (INHALE) som publicerades 2020 misslyckades också med att ge positiva resultat (inhalation av amikacinassisterade intravenösa antibiotika för gramnegativ bakteriell infektion orsakad av VAP-patienter, en dubbelblind, randomiserad, placebokontrollerad fas 3-effektstudie, totalt 807 patienter, systemisk medicinering + assisterad inhalation av amikacin i 10 dagar).
I detta sammanhang antog ett team lett av forskare från det regionala universitetssjukhuset Centre de Tours (CHRU) i Frankrike en annan forskningsstrategi och genomförde en forskarinitierad, multicenter, dubbelblind, randomiserad kontrollerad effektstudie (AMIKINHAL). Inhalerad amikacin eller placebo för förebyggande av ventrikulär anfall jämfördes i 19 patienter i Frankrike [13].
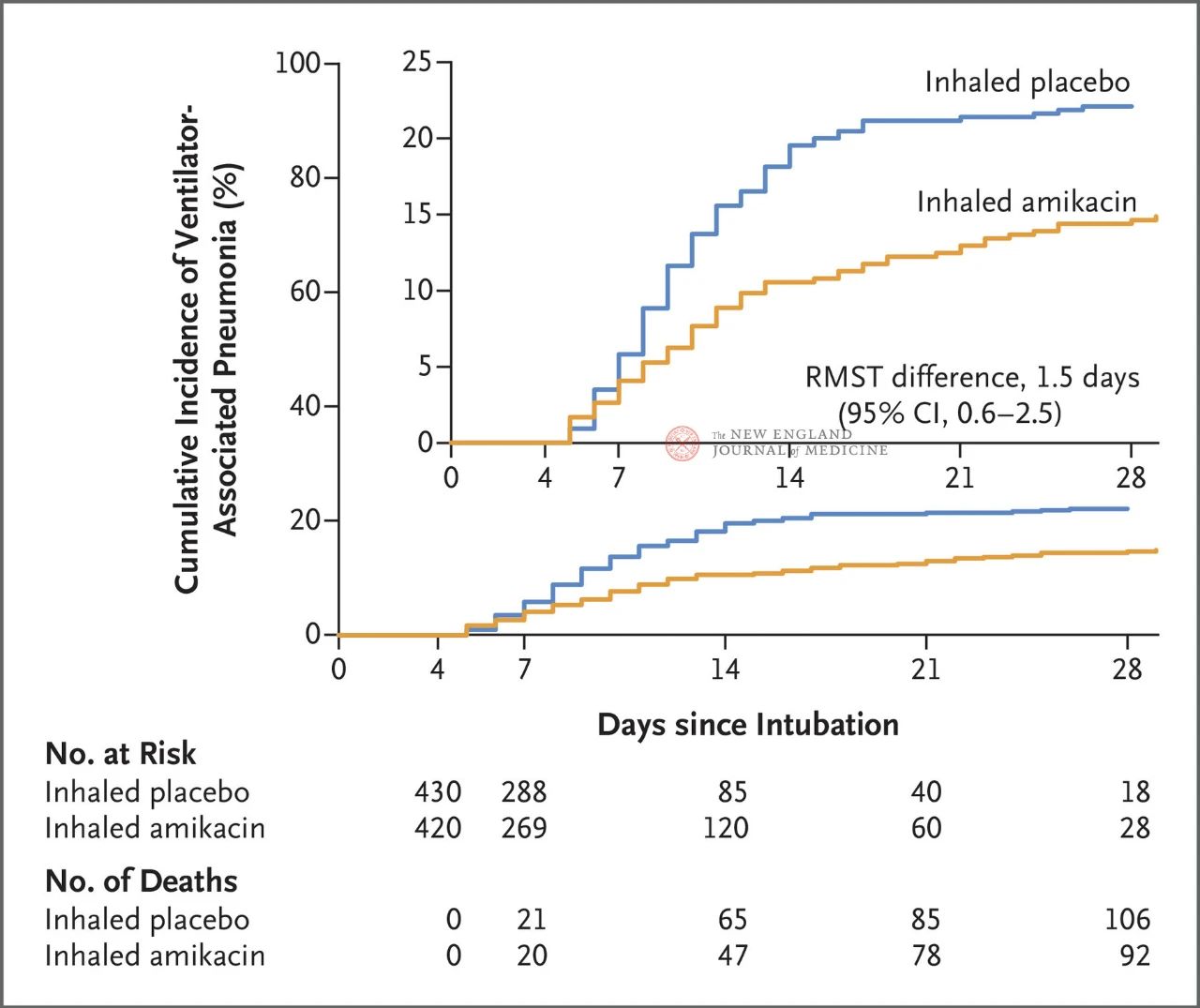
Totalt 847 vuxna patienter med invasiv mekanisk ventilation mellan 72 och 96 timmar randomiserades 1:1 till inhalation av amikacin (N = 417,20 mg/kg ideal kroppsvikt, QD) eller inhalation av placebo (N = 430, 0,9 % natriumkloridekvivalent) i 3 dagar. Det primära effektmåttet var den första episoden av invasiv mekanisk ventilation från början av den randomiserade tilldelningen till dag 28.
Resultaten av studien visade att vid 28 dagar hade 62 patienter (15 %) i amikacingruppen utvecklat väckarklocka för slemlöshet och 95 patienter (22 %) i placebogruppen hade utvecklat väckarklocka för slemlöshet (VAP) (den begränsade skillnaden i genomsnittlig överlevnad för VAP var 1,5 dagar; 95 % KI, 0,6–2,5; P=0,004).
När det gäller säkerhet upplevde sju patienter (1,7 %) i amikacingruppen och fyra patienter (0,9 %) i placebogruppen allvarliga biverkningar relaterade till studien. Bland dem som inte hade akut njurskada vid randomiseringen hade 11 patienter (4 %) i amikacingruppen och 24 patienter (8 %) i placebogruppen akut njurskada vid dag 28 (HR, 0,47; 95 % KI, 0,23~0,96).
Den kliniska prövningen hade tre höjdpunkter. För det första, vad gäller studiedesign, bygger AMIKINHAL-studien på IASIS-studien (en randomiserad, dubbelblind, placebokontrollerad, parallell fas 2-studie med 143 patienter). För att utvärdera säkerheten och effektiviteten hos amikacin-fosfomycin inhalationssystemisk behandling av gramnegativ bakteriell infektion orsakad av inhalationsanfall) och INHALE-studien, som avslutas med negativa resultat, har lärdomar dragits, vilka fokuserar på att förebygga inhalationsanfall, och erhållit relativt goda resultat. På grund av egenskaperna med hög dödlighet och lång sjukhusvistelse hos patienter med mekanisk ventilation och inhalationsanfall, kommer det att vara mer värdefullt för klinisk praxis om amikacininhalation kan uppnå signifikant olika resultat när det gäller att minska död och sjukhusvistelse hos dessa patienter. Med tanke på heterogeniteten i sen behandling och vård hos varje patient och varje center finns det dock ett antal störande faktorer som kan störa studien, så det kan också vara svårt att få ett positivt resultat som kan hänföras till inhalerade antibiotika. Därför kräver en framgångsrik klinisk studie inte bara utmärkt studiedesign, utan också valet av lämpliga primära effektmått.
För det andra, även om aminoglykosidantibiotika inte rekommenderas som ett enda läkemedel i olika riktlinjer för inhalation av slemlösande läkemedel (VAP), kan aminoglykosidantibiotika täcka vanliga patogener hos VAP-patienter (inklusive pseudomonas aeruginosa, acinetobacter, etc.), och på grund av deras begränsade absorption i lungepitelceller, höga koncentration vid infektionsstället och låga systemiska toxicitet. Aminoglykosidantibiotika är i stor utsträckning föredragna bland inhalerade antibiotika. Denna artikel överensstämmer med den omfattande uppskattningen av effektstorleken av intratrakeal administrering av gentamicin i små prover som publicerats tidigare, vilket tillsammans visar effekten av inhalerade aminoglykosidantibiotika för att förebygga VAP. Det bör också noteras att de flesta placebokontroller som valdes ut i studierna relaterade till inhalerade antibiotika är normal saltlösning. Med tanke på att finfördelad inhalation av normal saltlösning i sig kan spela en viss roll för att späda ut sputum och hjälpa till med slemlösande medel, kan normal saltlösning dock orsaka viss interferens i analysen av studieresultaten, vilket bör beaktas i stor utsträckning i studien.
Dessutom är lokal anpassning av HAP/VAP-medicinering viktig, liksom antibiotikaprofylax. Samtidigt, oavsett intubationstidens längd, är ekologin på den lokala intensivvårdsavdelningen den viktigaste riskfaktorn för infektion med multiresistenta bakterier. Därför bör den empiriska behandlingen i så stor utsträckning som möjligt hänvisa till mikrobiologiska data från lokala sjukhus och kan inte blint hänvisa till riktlinjer eller erfarenheter från tertiära sjukhus. Samtidigt är kritiskt sjuka patienter som behöver mekanisk ventilation ofta kombinerade med multisystemsjukdomar, och under den kombinerade inverkan av flera faktorer, såsom stresstillstånd, kan det också uppstå ett fenomen med tarmmikrober som överhör lungorna. Den höga heterogeniteten hos sjukdomar orsakade av intern och extern superposition avgör också att det är en lång väg att gå för det storskaliga kliniska främjandet av varje ny intervention.
Publiceringstid: 2 december 2023